
Reportáže a rozhovory z odborných kongresů
Chronická spontánní kopřivka je závažné onemocnění, v jehož pozadí stojí Brutonova kináza – signální enzym, který řídí aktivitu žírných buněk a podílí se na uvolňování prozánětlivých mediátorů. Novou nadějí cílené léčby se stávají inhibitory tohoto enzymu, zasahující s vysokou terapeutickou přesností přímo do základního patogenetického mechanismu urtikárie. Porozumění jejich úloze v regulaci imunitní odpovědi je pro efektivní využití těchto nových léčiv nezbytné.
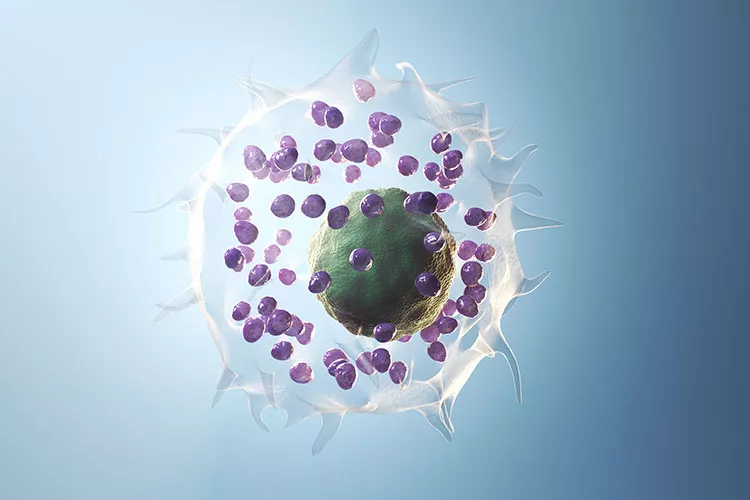
Chronická spontánní kopřivka (CSU) postihuje přibližně 0,5–1 % celosvětové populace, přičemž v některých regionech byla dokumentována prevalence až 1,4 %. V evropských zemích se pohybuje kolem 0,92 %. Nejčastěji postihuje ženy ve věku 30–50 let, přičemž až u 68 % postižených trvá onemocnění déle než jeden rok. Chronická povaha nemoci významně ovlivňuje nejen fyzické zdraví, ale také psychosociální fungování.
Dopad na kvalitu života bývá často dramatický a podceňovaný. Přibližně 40 % nemocných s CSU vykazuje hodnotu Dermatology Life Quality Index (DLQI) vyšší než 10, což odpovídá velkému negativnímu dopadu na kvalitu života, srovnatelnému nebo dokonce horšímu než u některých závažných chronických onemocnění, včetně psoriázy. Pacienti popisují nejen fyzické obtíže, jako je svědění a otok, ale také únavu, poruchy spánku a významné omezení v každodenních aktivitách. Psychologické komorbidity jsou zásadním aspektem zátěže. Úzkostné poruchy se vyskytují u 10–31 % a depresivní poruchy u 7–29 % nemocných s CSU. Tyto psychické problémy jsou často důsledkem nejen chronické povahy onemocnění, ale také nepředvídatelnosti symptomů a nedostatečné kontroly onemocnění při konvenční léčbě.
Brutonova tyrosinkináza (BTK) je cytoplazmatický protein z rodiny Tec signálních nereceptorových kináz o molekulové hmotnosti přibližně 76 kDa, který funguje jako hlavní přenašeč signálu v imunitních buňkách. Enzym je složen z pěti funkčních domén, které společně zajišťují jeho aktivitu a regulaci.
Řetězec událostí začíná na povrchu mastocytů a končí uvolněním histaminu a dalších mediátorů způsobujících symptomy kopřivky:
Uvolněný histamin způsobuje svědění, rozšíření cév a zvýšenou propustnost kapilár, což vede ke vzniku typických pomfů, popřípadě angioedému. Zánětlivou odpověď udržují a zesilují i další mediátory. Brutonova kináza je ale centrálním regulátorem – „spínačem“, bez kterého nemůže dojít k plné aktivaci žírných buněk. Bez funkční BTK je degranulace výrazně snížena, což bylo prokázáno v experimentech na buňkách bez BTK. Právě proto jsou inhibitory BTK tak účinné: blokují celý proces aktivace žírných buněk v jednom kritickém místě.
Více než polovina pacientů s CSU má autoimunitní mechanismus, což znamená, že jejich imunitní systém reaguje proti vlastním strukturám, a BTK hraje důležitou roli v obou hlavních typech autoimunity. Nemocní s autoimunitní CSU mají obvykle těžší průběh, horší odpověď na antihistaminika a vyšší potřebu biologické léčby.
Úloha BTK v rozvoji CSU je tedy dvojí. Je nezbytná pro aktivaci žírných buněk při obou typech autoimunity a důležitá je také pro funkci B-lymfocytů, které autoprotilátky produkují. Inhibitory BTK nejen blokují projevy onemocnění, ale mohou potenciálně ovlivnit i produkci autoprotilátek.
Inhibitory BTK byly původně vyvinuty pro léčbu B-buněčných malignit, kde BTK hraje kritickou roli v přežití a proliferaci nádorových B-lymfocytů. První generace inhibitorů BTK, reprezentovaná ibrutinibem, znamenala průlom v léčbě chronické lymfocytární leukemie a lymfomů z plášťových buněk. Její nevýhodou však byla omezená selektivita vůči cílovému enzymu. Ibrutinib vytváří kovalentní vazbu na cystein-481 v aktivním místě BTK, což je reziduum sdílené i s dalšími kinázami, a proto docházelo k nežádoucím účinkům způsobených off-target inhibicí. Nová generace inhibitorů BTK byla vyvinuta s cílem dosáhnout vyšší selektivity a příznivějšího bezpečnostního profilu, což otevřelo cestu k jejich využití i mimo onkologii – například u autoimunitních onemocnění. Tyto moderní inhibitory se nevážou pouze na kinázovou doménu, ale interagují i s dalšími oblastmi BTK, čímž dosahují větší specificity účinku. V dermatologii se zkoumá jejich potenciál nejen u chronické spontánní kopřivky, ale také u hidradenitis suppurativa.
Pochopení role BTK v patogenezi CSU má zásadní klinické důsledky. Brutonova kináza představuje v patogenezi chronické spontánní kopřivky centrální „spínač“ v signální dráze vedoucí k aktivaci žírných buněk. Inhibitory BTK, především remibrutinib, který prokázal působivou účinnost v klinických studiích fáze III (REMIX-1 a REMIX-2) u 925 pacientů s CSU, jsou novou třídou perorálních léčiv, cílících přímo na rozhodující mechanismus aktivace mastocytů. Na rozdíl od antihistaminik, která blokují pouze jeden mediátor (histamin), inhibitory BTK komplexně zabraňují degranulaci a uvolnění celého spektra prozánětlivých mediátorů. Tím se i v dermatologii rozšiřují terapeutické možnosti pro pacienty, u nichž konvenční léčba dosud nepřinášela uspokojivé výsledky.
Redakčně zpracováno ze sdělení, které na sympoziu PrimeTime Academy 31. 5. 2025 v Praze přednesl:
MUDr. Miroslav Nečas, Ph.D.
I. dermatovenerologická klinika LF MU a FN u svaté Anny v Brně

Reportáže a rozhovory z odborných kongresů
Opouštíte prostředí společnosti Pfizer, spol. s r. o.
Společnost Pfizer, spol. s r. o., neručí za obsah stránek, které hodláte navštívit.
Přejete si pokračovat?